
Nina Vierengel, Forschungsgruppe Prof. Opatz
Kontaktmail: vierengel(at)uni-mainz(dot)de
Studiengang: Biomedizinische Chemie Bachelor & Master
Johannes Gutenberg-Universität Mainz
Thema der Promotion
Chemische Synthese entzündungshemmender Makrolaktone
Bachelorarbeit
Titel: Proteinogene Aminosäuren in ihrer Eignung als alternative nicht-toxische Cyanidquellen in der präparativen organischen Chemie
Inhalt: Bei Cyanierungsreaktionen wird die Cyanidquelle oft direkt dem Reaktionsgemisch zugesetzt, was die Wahl der Bedingungen einschränkt. Stattdessen bietet die physikalische Trennung von Cyanidfreisetzung und -verbrauch eine größere Flexibilität. Ein solcher Aufbau wurde für die Cyanierung von Iminiumionen mit natürlich vorkommenden alpha-Aminosäuren als einfach zu handhabende Cyansäurequelle verwendet. Die Substrate wurden zunächst durch oxidative Decarboxylierung in ihre entsprechenden Nitrile umgewandelt. Es wurde festgestellt, dass Glycin in der Oxidationsstufe direkt Cyansäure lieferte, die in einer beispielhaften Cyanierungsreaktion verbraucht wurde. Für komplexere Aminosäuren wurde ein vielversprechender Ansatz für ihre Nutzung als Cyanidquelle entwickelt.
Betreut durch: Prof. Dr. Till Opatz und Dr. Alexander Nauth, Johannes Gutenberg-Universität Mainz
Masterarbeit
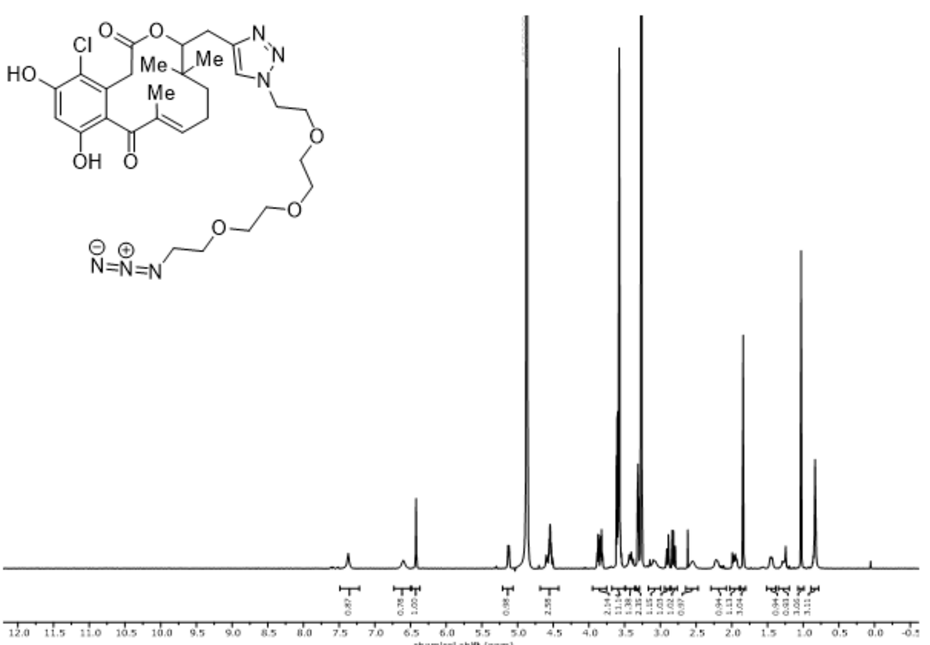
Titel: Synthese eines funktionalisierten Makrolactons für den Einsatz in der Affinitätschromatographie
Inhalt: Ziel der Arbeit war es, ein entzündungshemmendes Makrolacton vom Oxacyclododecindion-Typ mit einem Diazid-PEG3-Spacer zu versehen, sodass es kovalent an funktionalisierte Harzkügelchen gebunden werden kann. Mit dem so hergestellten Säulenmaterial soll die Targetidentifizierung dieser Molekülfamilie durch Affinitätschromatographie ermöglicht werden.
Zu diesem Zweck wurde in 15-Position des Makrolactons eine Propargylgruppe eingeführt. Für die Syntheseroute wurde dabei auf bewährte totalsynthetische Zugänge zurückgegriffen und das Zielmolekül konnte ausgehend von delta-Valerolacton in 12 linearen Stufen hergestellt werden. Im folgenden letzten Schritt wurde der ausgewählte Diazid-PEG3-Spacer erfolgreich in einer kupferkatalysierten Azid/Alkin-Cycloaddition angebracht. Das so hergestellte Material ließ sich nach einer kupferfreien Azid-Alkin-Cycloaddition mit einem NHS-funktionalisiertem Cyclooctin kovalent an aminfunktionalisierte Agarosebeads binden. Dieses Material wird in der AG Erkel von der TU Kaiserslautern auf seine Eignung zur Targetidentifizierung von Oxacyclododecindion-Makrolactonen untersucht.
Betreut durch: Prof. Dr. Till Opatz, Johannes Gutenberg-Universität Mainz
Bisherige Publikationen, Poster, Vorträge, Kongressteilnahmen
Lipp A, Ferenc D, Gütz C, Geffe M, Vierengel N, Schollmeyer D, Schäfer HJ, Waldvogel SR, Opatz T (2018), A Regio- and Diastereoselective Anodic Aryl-Aryl-Coupling in the Biomimetic Total Synthesis of (–)-Thebaine, Angewandte Chemie International Edition 57, 11055-11059.
Nauth A. M., Konrad T., Papadopulu Z., Vierengel N., Lipp B., Opatz T., (2018) Synthesis of α-Aminonitriles using Aliphatic Nitriles, α-Amino Acids, and Hexacyanoferrate as Universally Applicable Non-Toxic Cyanide Sources, Green Chem., 20, 4217-4223.
Lieblingsbild aus Abschlussarbeit
Wichtiger Satz warum ich wissenschaftlich arbeiten will
Mein Ansporn ist die Möglichkeit, mit meinen synthetischen Fähigkeiten ein tolles, interdisziplinäres Team unterstützen zu können und dabei wertvolle Erkenntnisse zu einer ungewöhnlichen, aber faszinierenden Naturstoffklasse zu erlangen.