
Kevin Seipp, Forschungsgruppe Prof. OPATZ
Kontaktmail: kseipp(at)uni-mainz(dot)de
Studiengang: Chemie, B.Sc. & M.Sc. 2014-2019
Philipps-Universität Marburg
Thema der Promotion
Totalsynthese und Derivatisierung komplexer chiraler Sekundärmetabolite aus Pilzen und Blaualgen
Bachelorarbeit
Titel: Funktionalisierung von β-hairpin Peptiden des eukaryotischen Translations-Initiierungsfaktors 5a mit klinisch relevanten Tuberkulose-Wirkstoffen auf der Basis von reversibler Chemie in Wasser
Inhalt: Im Rahmen meiner Bachelorarbeit erfolgte die gezielte Funktionalisierung von klinisch relevanten Tuberkulose (TB)-Wirkstoffen (Cycloserin, Levofloxacin), die später zur Anbindung an einen Ausschnitt des Proteins eIF-5a dienen sollten. Dieses Protein spielt in der Immunologie eine bedeutsame Rolle und wird oftmals in Zusammenhang mit der HIV-Therapie gebracht. Bezugnehmend zur Aufgabenstellung, soll durch die Anbindung der modifizierten TB-Wirkstoffe eine selektive Freisetzung der Antibiotika an dessen Wirkungsort ermöglicht werden (drug-targeting). Die Anbindung sollte dabei sowohl reversible, als auch irreversibel erfolgen. Im reversiblen Fall dienten die eingebrachten Funktionalitäten der Boronsäure und des Boroxols an den TB-Wirkstoffen als Modellsystem. Der Ausschnitt des Proteins wurde N-terminal mit einer vicinalen Diol-Funktionalität versehen. Durch Variation des pH-Wertes konnte so eine Steuerung der Anbindung erfolgen. Zusätzlich zur reversiblen Anbindung erfolgte ebenfalls die kovalent irreversible Anbindung auf Basis der Amidbindung. Die Tuberkulose-Wirkstoffe wurden mit einer Carboxylgruppe funktionalisiert und anschließend über klassische Methoden der Festphasenpeptidsynthese kovalent an den Ausschnitt des eIF-5a angebunden. Neben diesen biomedizinisch motivierten Themen und der klassischen organischen Synthese erfolgte ebenfalls die kinetische Untersuchung der Boroxinbildung und dessen Stabilität aus diversen Boronsäuren, auf Basis der NMR-Spektroskopie.
Betreut durch: Prof. A. Geyer, Philipps-Universität Marburg 2017
Masterarbeit
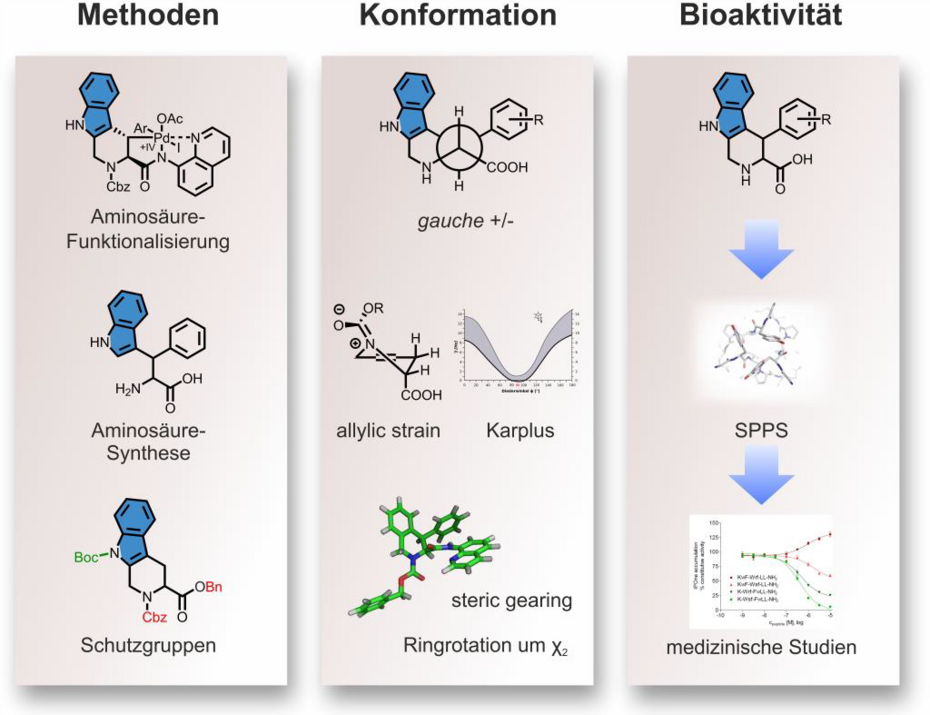
Titel: Synthese konformationell eingeschränkter Aminosäurebausteine auf Basis des Struktur-motivs der Pipecolinsäure
Inhalt: Die Thematik meiner Master-Arbeit beinhaltete als Basiskonzept die konformationell eingeschränkte Aminosäure auf Basis des Strukturmotivs der Pipecolinsäure. Beispiele dieser Aminosäuren sind Diphenylalanin (Dip) oder Tetrahydroisochinolin-3-carbonsäure (Tic), welche in der medizinischen Chemie oftmals angewendete Tools zur Erhöhung der metabolischen Stabilität und Hydrophobizität, als auch der Erniedrigung der Freiheitsgrade sind. Das Ziel meiner Masterarbeit war die Darstellung der in 3-Position arylierten Tic-Aminosäure. Dies erfolgte sowohl über die klassische Pictet-Spengler Reaktion des Dip, als auch durch die moderne Pd-katalysierte C-H Aktivierung von Tic. Im Fall der Pictet-Spengler Reaktion ist die asymmetrische Durchführung hin zu den jeweiligen trans-Isomeren gelungen. Die C-H Aktivierung hingegen resultierte in den cis-Isomeren, sodass die Kombination aus klassischer und moderner Synthesestrategie die Darstellung aller gewünschten Stereoisomere ermöglicht. In beiden Fällen erfolgte die detaillierte Analyse der Ringkonformationen des Übergangszustandes und der Zwischenprodukte auf Basis der NMR-Spektroskopie, was eine Aussage über den zurückgelegten Reaktionspfad zulässt.
Dabei wurden ebenfalls die Grundtheorien der organischen Chemie in Bezug auf die dargestellten cyclischen Systeme angewendet (z.B. pseudo-Allylspannung, cis/trans-Amidisomerie). Nach der erfolgreichen Darstellung der äquivalenten anellierten und substituierten Arylfunktionalitäten, wurden die Synthesemethoden auf heteroaromatische Funktionalitäten ausgeweitet. Im Anschluss an die Darstellung der kompatiblen Bausteine für die Festphasenpeptidsynthese erfolgte dessen Einbau in bioaktive Peptide. Diese wurden abschließend von Prof. Dr. A. Hübner an der TU Dresden in
medizinischen Testsystemen des ACTH-Hormons untersucht.
Betreut durch: Prof. A. Geyer, Philipps-Universität Marburg 2019
Bisherige Publikationen, Poster, Vorträge, Kongressteilnahmen
F. Daus, E. Pfeifer, K. Seipp, N. A. Hampp, A. Geyer, The role of phosphopeptides in the mineralisation of silica, Organic & Biomolecular Chemistry, 2020, 18, 700 – 706.
Lieblingsbild aus Abschlussarbeit
Wichtiger Satz warum ich wissenschaftlich arbeiten will
Das Verständnis über die Natur und ihre Vorgänge stellte schon zu Beginn meines Studiums einer der Triebkräfte dar. Die wissenschaftliche Arbeit ermöglicht es mir diese Vorgänge weiter zu verstehen und neue Erkenntnisse zu gewinnen, welche den Menschen von Nutzen sein können.